Wie könnte das Salz den Resublimationspunkt beeinflüssen?
Wird es dann erst bei noch tieferen Temperaturen fest?
Salze sind ein gutes Frostschutzmittel, Meerwasser friert z.B. bei -1,9 °C [
Quelle]. Wasser besteht aus einem Sauerstoff und zwei Wasserstoff-Atomen, die über polare Wasserstoffverbindungen miteinander verbunden sind. Auch zwischen verschiedenen Wassermolekülen gibt es gewisse Anziehungskräfte, die man
Wasserstoffbrücken bezeichnet. Dabei "bindet" sich ein Wasserstoffatom des einen an ein Sauerstoffatom eines anderen Wassermoleküls:
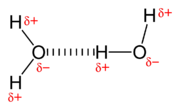
Natürlich sind Wasserstoffbrücken in
flüssigem Wasser nur schwach und wirken temporär, da ja alle Moleküle in Bewegung sind. Allerdings verursachen sie die besonderen chemischen Eigenschaften des Wassers. Wenn jetzt aber andere (geladenen!) Ionen im Wasser gelöst sind, kann die Wirkung der Wasserstoffbrücken abgeschwächt werden. Z.B. bei Kochsalz: Hier schwirren dann [tex]Na^{+}[/tex]- und [tex]Cl^{-}[/tex]-Ionen herum, die die Wirkung der Wasserstoffbrückenbindungen reduzieren.
Das Resultat: Man bringt die Wassermoleküle schwerer dazu, zu einem festen Kristall zusammenzuwachsen, weil für ihr Kristallsystem völlig unpassende Salzionen dazwischen hängen.
Und nun zu Eumels Frage: Demnach dürfen Salze den Resublimationspunkt nicht beeinflussen, da weder festes noch gasförmiges Wasser Salze lösen bzw. einbauen kann.